奇點網
免疫治療是目前癌症治療的一個火爆領域,雖然已經有好幾款藥物上市,但這個領域可挖掘的還有非常多。
在前不久的《細胞》雜誌上[1],德國癌症研究中心和柏林健康研究所的研究人員發表了新的研究成果,他們找到了一個癌症免疫治療的新潛在靶點——IL4I1,IL4I1是一個代謝酶,由腫瘤產生,分解色氨酸得到的代謝物能夠激活芳烴受體(AHR),從而增強腫瘤的侵襲性,還抑制抗腫瘤免疫。因此,IL4I1抑制可能是一種新的免疫治療途徑。
芳烴受體最初被發現是因為介導了二噁英(芳烴類化合物,工業生產和焚燒產生的有害物質)的毒性作用,在近20年內,研究人員發現,AHR參與調解多個生理過程,包括血管生成、造血、藥物和脂質代謝、細胞運動和免疫調節。
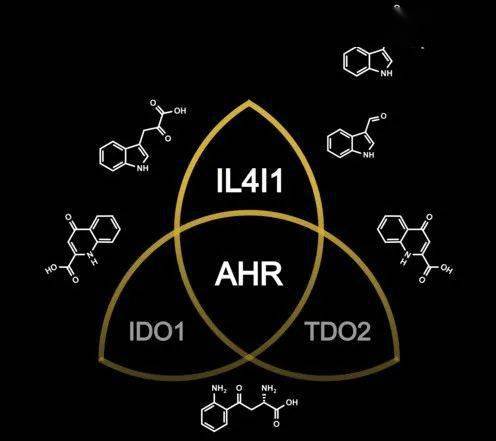
激活芳烴受體的配體除了可以是來自環境、飲食的外源物質,微生物和細胞代謝的產物也是一大來源,例如色氨酸的代謝產物[2],而人最主要的色氨酸代謝途徑就是吲哚胺-2,3-雙加氧酶1/2(IDO1/2)和色氨酸-2,3-雙加氧酶(TDO2)這兩種。

色氨酸(圖片來自wiki)
常常關注癌症領域的朋友們對IDO1和TDO2想必是很眼熟的,這兩種色氨酸代謝酶都在多種類型的腫瘤中有高表達,分解色氨酸產生犬尿氨酸,與芳烴受體結合,增強癌細胞的運動性,同時也誘導調節性T細胞抑制殺傷性T細胞的增殖和功能,誘導殺傷性T細胞上PD-1的表達,以及殺傷性T細胞的死亡。
因此,IDO1抑製劑就基於這些問題被研發出來了。然而,2019年,首個IDO1抑製劑的III期臨床試驗宣告失敗[3],在失敗的經驗總結中,雖然研究人員認為有部分原因是沒有基於IDO1表達水平對患者進行分層,但也有觀點認為與目前對底層機制的認識不足有關。
因此,研究人員假設,芳烴受體可能有其他激活途徑,導致了對IDO1抑製劑的抵抗。為了驗證這個假設,他們進行了這次研究。
他們分析了來自TCGA數據庫的32種不同類型的腫瘤,大部分腫瘤中,IDO1或TDO2高表達的,芳烴受體也處於高水平。通過WGCNA分析(加權基因共表達網絡分析,可以將具有相似共表達模式的基因分類到不同模塊中),32種腫瘤中有23種,IDO1和TDO2與芳烴受體存在於同一模塊,而另外9種則不存在,說明有其他色氨酸代謝酶激活了芳烴受體。
為了搞清楚這個隱藏的“大佬”,研究人員對7種色氨酸代謝酶進行了重複分析,發現IL4I1居然是芳烴受體相關模塊中出現率最高的一個,甚至比IDO1和TDO2都要高,也就是說,在多種人類腫瘤中,與芳烴受體活性相關性最強的,是IL4I1。
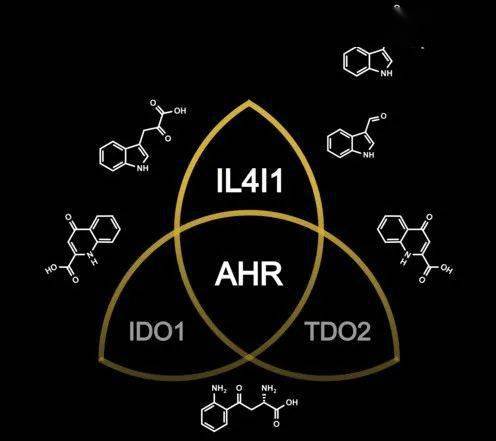
IL4I1、IDO1和TDO2均是可激活芳烴受體的色氨酸代謝酶(圖片來自Luis F. Somarribas Patterson)
這讓研究人員挺吃驚的,因為在此之前,IL4I1主要被發現是可以催化苯丙氨酸氧化脫氨為苯丙酮酸,還沒有發現過它能夠在芳烴受體信號通路中發揮作用。於是他們對IL4I1進行了更深入的研究。
在腦膠質瘤細胞模型中,IL4I1的增加提高了芳烴受體的活性和靶基因,包括IDO1和TDO2的轉錄,反之,IL4I1減少,降低了芳烴受體活性和靶基因的轉錄。那麼IL4I1是通過誰來激活芳烴受體的呢?
和以前的研究一致,在培養過程中,IL4I1會消耗苯丙氨酸、酪氨酸和色氨酸,分別產生苯丙酮酸、羥基苯丙酮酸和吲哚-3-丙酮酸,用它們三個去誘導芳烴受體,研究人員確定了,是吲哚-3-丙酮酸激活了芳烴受體,和犬尿氨酸(就是前面說過的被IDO1和TDO2分解後產生激活芳烴受體的那個)相比,吲哚-3-丙酮酸能夠以更低的濃度完成任務。
還是腦膠質瘤細胞模型,吲哚-3-丙酮酸以芳烴受體依賴性的方式,增強了細胞的運動性。激活了殺傷性T細胞中的芳烴受體,並且減少了它們的增殖。
在腦膠質瘤和低度惡性淋巴瘤患者的腫瘤樣本中,都檢測到了IL4I1的表達,高水平的IL4I1與兩種患者的存活率降低均有關。與低水平相比,高水平患者的死亡風險分別增加了2.3倍和3.3倍。
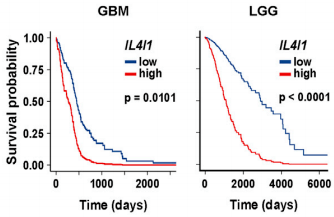
IL4I1低水平(藍)和高水平(紅)的腦膠質瘤(左)和低度惡性淋巴瘤(右)患者生存率對比
除了以上兩種腫瘤,在大多數實體瘤患者中,與正常組織相比,腫瘤組織中IL4I1的表達都明顯更高,瀰漫性大B細胞淋巴瘤是最高的。不但如此,IL4I1的表達基本都要高於IDO1和TDO2,也就是說,IL4I1也是腫瘤中的一個主要的色氨酸代謝酶。
高表達IL4I1的腫瘤表現出一些免疫細胞,如骨髓來源的抑制細胞(MDSC)和調節性T細胞的富集,多組學因素分析表明,IL4I1與多藥耐藥幹細胞和調節性T細胞的存在密切相關。恰巧,MDSC和調節性T細胞的富集也是慢性淋巴細胞白血病的特徵,在復發性患者中,IL4I1的表達也與芳烴受體的激活有關。
因此,研究人員在慢性淋巴細胞白血病小鼠模型中進行了實驗,再次驗證了IL4I1與癌細胞的運動性增加和免疫抑制有關,而抑制IL4I1則改善了殺傷性T細胞的細胞功能。這意味著,IL4I1是一個新的腫瘤代謝檢查點。
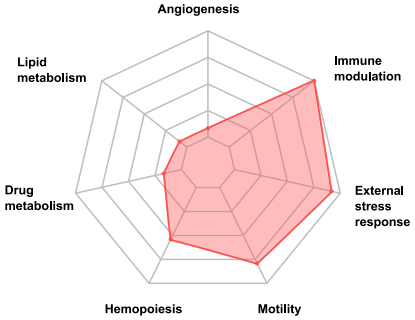
IL4I1激活芳烴受體後的芳烴受體相關模塊的特徵,最重要的3點:免疫調節、外部壓力響應和細胞運動鞋
另外,在一項PD-1單抗nivolumab治療的晚期黑色素瘤患者試驗中,研究人員觀察到了IDO1和IL4I1的增加,這個隊列中有一部分患者先前接受過ipilimumab治療,而對於其他未接受過ipilimumab但接受了nivolumab治療的患者,IL4I1的水平也有顯著增加。
雖然之前認為IDO1可能是導致PD-1抑製劑不起效的原因,但IDO1抑製劑與PD-1抑製劑聯合治療的臨床試驗卻失敗了,基於這次的研究,研究人員認為,或許IL4I1正是試驗失敗的原因所在,IDO1抑製劑無法抑制IL4I1的活性。
對於這項研究,通訊作者Christiane Opitz博士表示,IL4I1有成為治療靶點的巨大潛力,目前,色氨酸代謝酶抑製劑在臨床試驗中並沒有取得好的效果,而IL4I1的作用一直被忽略了,它的臨床應用價值值得研究人員去探索[4]。
[1] Sadik A, Patterson LFS, Öztürk S, et al. IL4I1 Is a Metabolic Immune Checkpoint that Activates the AHR and Promotes Tumor Progression[J]. Cell, 2020.
[2] Nguyen LP, Bradfield C A. The Search for Endogenous Activators of the Aryl Hydrocarbon Receptor[J]. Chemical Research in Toxicology, 2008, 21(1): 102-116.
[3] Georgina V Long, et al. Epacadostat plus pembrolizumab versus placebo plus pembrolizumab in patients with unresectable or metastatic melanoma (ECHO-301/KEYNOTE-252): a phase 3, randomi[J]. Lancet Oncology, 2019, 20( 8): 1083-1097.
[4] https://www.bihealth.org/en/notices/a-potential-new-target-for-immunotherapies-in-cancer/